Was erwartet Dich?
Hinweis zur Kursbuchung
Hey, cool, dass du hier bist und dich für die Medizintechnik interessierst! Wir geben diesem Kurs derzeit ein kleines Update, sodass du hier demnächst noch bessere Lerninhalte findest. Daher kannst du den Kurs aktuell noch nicht buchen, aber ganz bald! Danke für dein Verständnis und bis bald!
Wie ist das Lernmaterial aufgebaut?
Internationale Märkte und Zulassung
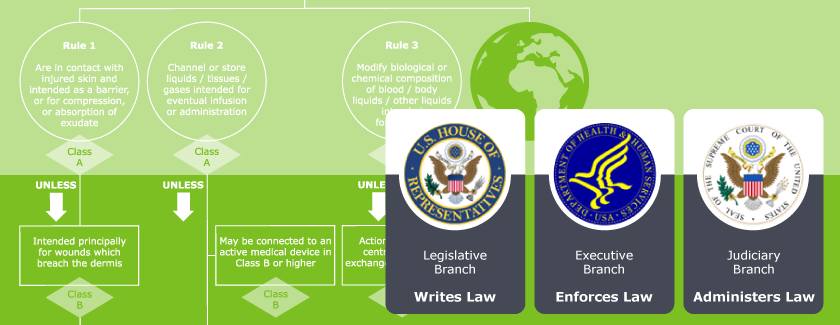
1. Das regulatorische System für Medizinprodukte in den Vereinigten Staaten von Amerika - United States: Medical device regulatory system
2. Das regulatorische System für Medizinprodukte in Kanada - Canada: Medical device regulatory system
3. Das regulatorische System für Medizinprodukte in China - China: Medical device regulatory system
4. Das regulatorische System für Medizinprodukte in Japan - Japan: Medical device regulatory system
5. Das regulatorische System für Medizinprodukte in Brasilien - Brazil: Medical device regulatory system
6. Internationale und überregionale Konsensuskonzepte und –verfahren für die Zulassung und Konformitätsbewertung von Medizinprodukten
Kooperationspartner



0 Bewertungen
5 Sterne |
0% | |
4 Sterne |
0% | |
3 Sterne |
0% | |
2 Sterne |
0% | |
1 Stern |
0% |